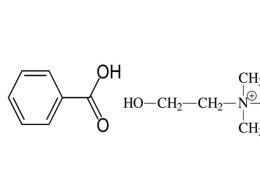
Презентация на тему "искусственные органы". Искусственные механические органы Искусственные органы
Успехи биологии и медицины в новейшей истории существенно продлили среднюю продолжительность жизни и избавили мир от дамоклова меча многих смертельных болезней. Но не все болезни побеждены, да и жизнь человека, тем более активная, все еще кажется нам слишком короткой. Даст ли наука шанс сделать следующий рывок?
Новая кожа Сотрудник лаборатории достает из ванночки полоску искусственно выращенного эпидермиса. Ткань создали в дерматологическом институте в итальянском городе Помеция, Италия, под руководством профессора Микеле де Лука.
Олег Макаров
Основания для оптимизма, конечно же, есть. В наши дни в науке наметилось несколько направлений, которые, возможно, позволят в близком или дальнем будущем превратить Homo sapiens в более долговечную и надежную мыслящую конструкцию. Первое — это создание электронно-механических «подпорок» для недужного тела. Речь идет о роботизированных бионических протезах конечностей, достоверно воспроизводящих человеческую локомоторику, или даже целых экзоскелетах, которые смогут подарить радость движения парализованным.
 Выращивание нервной ткани — наиболее сложно из-за многообразия типов составляющих ее клеток и их сложной пространственной организации. Однако на сегодня существует успешный опыт выращивания аденогипофиза мыши из скопления стволовых клеток.
Выращивание нервной ткани — наиболее сложно из-за многообразия типов составляющих ее клеток и их сложной пространственной организации. Однако на сегодня существует успешный опыт выращивания аденогипофиза мыши из скопления стволовых клеток.
Эти хитроумные изделия дополнит нейромашинный интерфейс, который позволит считывать команды прямо с соответствующих участков головного мозга. Действующие прототипы подобных устройств уже созданы, теперь главное — их совершенствование и постепенное удешевление.
Вторым направлением можно считать исследования генетических и прочих микробиологических процессов, вызывающих старение. Познание этих процессов, возможно, в будущем даст возможность затормозить увядание организма и продлить активную жизнь за вековой предел, а возможно, и далее.
 Поиски ведутся в нескольких направлениях. Одно из них — бионический глаз: электронная камера плюс чип, имплантированный в сетчатку. Есть и некоторые успехи в выращивании сетчатки (пока у мышей).
Поиски ведутся в нескольких направлениях. Одно из них — бионический глаз: электронная камера плюс чип, имплантированный в сетчатку. Есть и некоторые успехи в выращивании сетчатки (пока у мышей).
И наконец, к третьему направлению относятся исследования в области создания подлинных запчастей к человеческому телу — тканей и органов, которые структурно и функционально будут мало чем отличаться от природных и позволят своевременно «отремонтировать» организм, пораженный тяжелой болезнью или возрастными изменениями. Известия о новых шагах в этой области приходят сегодня едва ли не ежедневно.
Запускаем печать
Базовая технология выращивания органов, или тканевой инженерии, заключается в использовании эмбриональных стволовых клеток для получения специализированных клеток той или иной ткани, например гепатоцитов — клеток паренхимы (внутренней среды) печени. Эти клетки затем помещаются внутрь структуры соединительной межклеточной ткани, состоящей преимущественно из белка коллагена.
 Наряду с созданием электронно-механических протезов ведется поиск более естественного имплантата, объединяющего в себе выращенные ткани сердечной мускулатуры с наноэлектронной системой контроля.
Наряду с созданием электронно-механических протезов ведется поиск более естественного имплантата, объединяющего в себе выращенные ткани сердечной мускулатуры с наноэлектронной системой контроля.
Таким образом обеспечивается заполнение клетками всего объема выращиваемого органа. Матрицу из коллагена можно получить путем очистки от клеток донорской биологической ткани или, что гораздо проще и удобнее, создать ее искусственным путем из биоразрушаемых полимеров или специальной керамики, если речь идет о кости. В матрицу помимо клеток вводятся питательные вещества и факторы роста, после чего клетки формируют единый орган или некую «заплатку», призванную заместить собой пораженную часть.
Правда, выращивание искусственной печени, легкого и других жизненно важных органов для пересадки человеку сегодня пока недостижимо, в более простых случаях такая методика успешно применяется. Известен случай пересадки пациентке выращенной трахеи, осуществленной в РНЦ хирургии им. Б.В. Петровского под руководством итальянского профессора П. Маккиарини. В данном случае в качестве основы была взята донорская трахея, которую тщательно очистили от клеток. На их место были введены стволовые клетки, взятые из костного мозга самой пациентки. Туда же были помещены факторы роста и фрагменты слизистой оболочки — их также позаимствовали из поврежденной трахеи женщины, которую предстояло спасти.
 Проведены успешные эксперименты по имплантации крысе легкого, выращенного на очищенной от клеток донорской матрице.
Проведены успешные эксперименты по имплантации крысе легкого, выращенного на очищенной от клеток донорской матрице.
Недифференцированные клетки в таких условиях дали начало клетками дыхательного эпителия. Выращенный орган имплантировали пациентке, причем были приняты специальные меры для проращивания имплантата кровеносными сосудами и восстановления кровообращения.
Впрочем, уже существует метод выращивания тканей без применения матриц искусственного или биологического происхождения. Метод нашел воплощение в устройстве, известном как биопринтер. В наши дни биопринтеры «выходят из возраста» опытных образцов, и появляются мелкосерийные модели. Например, аппарат компании Organovo способен распечатать фрагменты тканей, содержащих 20 и более клеточных слоев (причем туда входят клетки разных типов), объединенных межклеточной тканью и сетью кровеносных капилляров.
 До выращивания целой искусственной печени еще далеко, однако фрагменты ткани печени человека уже получены методом выращивания на матрице из биоразлагаемых полимеров. Такие имплантаты смогут помочь в восстановлении пораженных участков.
До выращивания целой искусственной печени еще далеко, однако фрагменты ткани печени человека уже получены методом выращивания на матрице из биоразлагаемых полимеров. Такие имплантаты смогут помочь в восстановлении пораженных участков.
Соединительная ткань и клетки собираются воедино по той же технологии, которую используют при трехмерной печати: движущаяся головка, позиционирующаяся с микронной точностью в трехмерной сети координат, «выплевывает» в нужную точку капельки, содержащие либо клетки, либо коллаген и другие вещества. Разные производители биопринтеров сообщили, что их устройства уже способны распечатывать фрагменты кожи подопытных животных, а также элементы почечной ткани. Причем в результате удалось достичь правильного расположения клеток разных типов друг относительно друга. Правда, эпохи, когда принтеры в клиниках будут способны создавать органы разного назначения и больших объемов, придется еще подождать.

Мозг под замену
Развитие темы запчастей для человека неизбежно приводит нас к теме самого сокровенного — того, что делает человека человеком. Замена мозга — пожалуй, самая фантастическая идея, касающаяся потенциального бессмертия. Проблема, как нетрудно догадаться, в том, что мозг — похоже, самый сложный из известных человечеству материальных объектов во Вселенной. И, возможно, один из самых непонятных. Известно, из чего он состоит, но очень мало известно о том, как он работает.
 Новая кожа. Сотрудник лаборатории достает из ванночки полоску искусственно выращенного эпидермиса. Ткань создали в дерматологическом институте в г. Помеция, Италия, под руководством профессора Микеле де Лука.
Новая кожа. Сотрудник лаборатории достает из ванночки полоску искусственно выращенного эпидермиса. Ткань создали в дерматологическом институте в г. Помеция, Италия, под руководством профессора Микеле де Лука.
Таким образом, если мозг удастся воссоздать как совокупность нейронов, устанавливающих друг с другом связи, надо еще придумать, как поместить в него всю необходимую человеку информацию. Иначе в лучшем случае мы получим взрослого человека с «серым веществом» младенца. Несмотря на всю сверхфантастичность конечной цели, наука активно работает над проблемой регенерации нервной ткани. В конце концов, цель может быть и скромнее — например, восстановление части мозга, разрушенной в результате травмы или тяжелого заболевания.
Проблема искусственной регенерации мозговой ткани усугубляется тем, что мозг обладает высокой гетерогенностью: в нем присутствует множество типов нервных клеток, в частности тормозные и возбуждающие нейроны и нейроглия (буквально — «нервный клей») — совокупность вспомогательных клеток нервной системы. Кроме того, разные типы клеток определенным образом расположены в трехмерном пространстве, и это расположение необходимо воспроизвести.
 Это тот самый случай, когда технологии выращивания тканей уже работают в медицине и спасают жизни людей. Известны случаи успешной имплантации трахеи, выращенной на донорской матрице из клеток спинного мозга пациента.
Это тот самый случай, когда технологии выращивания тканей уже работают в медицине и спасают жизни людей. Известны случаи успешной имплантации трахеи, выращенной на донорской матрице из клеток спинного мозга пациента.
Нервный чип
В одной из лабораторий знаменитого Массачусетского технологического института, известного своими разработками в сфере информационных технологий, подошли к созданию искусственной нервной ткани «по-компьютерному», применив элементы технологии изготовления микрочипов.
Исследователи из Бостона взяли смесь нервных клеток, полученных из первичной коры мозга крысы, и нанесли их на тончайшие пластины гидрогеля. Пластины образовали своего рода сэндвич, и теперь задача состояла в том, чтобы вычленить из него отдельные блоки с заданной пространственной структурой. Получив такие прозрачные блоки, ученые намеревались изучать процессы возникновения нервных связей внутри каждого из них.
 Технология пересадки человеку мочевого пузыря, выращенного на коллагеновой матрицы из мочевого пузыря или тонкой кишки животного происхождения, уже создана и имеет положительную практику применения.
Технология пересадки человеку мочевого пузыря, выращенного на коллагеновой матрицы из мочевого пузыря или тонкой кишки животного происхождения, уже создана и имеет положительную практику применения.
Задача была решена с помощью фотолитографии. На пласты гидрогеля накладывались пластиковые маски, которые позволяли свету воздействовать лишь на определенные участки, «сваривая» их воедино. Так удалось получить разнообразные по размерам и толщине композиции клеточного материала. Изучение этих «кирпичиков» со временем может привести к созданию значимых фрагментов нервной ткани для использования в имплантах.
Если инженеры MIT подходят к изучению и воссозданию нервной ткани в инженерном стиле, то есть механически формируя нужные структуры, то в Центре биологии развития RIKEN в японском городе Кобе ученые под руководством профессора Йошики Сасаи нащупывают другой путь — evo-devo, путь эволюции развития. Если плюрипотентные стволовые клетки эмбриона могут при делении создавать самоорганизующиеся структуры специализированных клеток (то есть разнообразные органы и ткани), то нельзя ли, постигнув законы такого развития, направлять работу стволовых клеток для создания имплантатов уже с природными формами?
 В деле выращивания костей и хрящей на матрицах достигнут большой прогресс, однако восстановление нервной ткани спинного мозга — дело будущего.
В деле выращивания костей и хрящей на матрицах достигнут большой прогресс, однако восстановление нервной ткани спинного мозга — дело будущего.
И вот главный вопрос, на который намеревались найти ответ японские биологи: насколько зависит развитие конкретных клеток от внешних факторов (например, от контакта с соседними тканями), а в какой степени программа «зашита» внутри самих стволовых клеток. Исследования показали, что есть возможность вырастить из изолированной группы стволовых клеток заданный специализированный элемент организма, хотя внешние факторы играют определенную роль — например, необходимы определенные химические индуцирующие сигналы, заставляющие стволовые клетки развиваться, скажем, именно как нервная ткань. И для этого не понадобится никаких поддерживающих структур, которые придется наполнять клетками — формы возникнут сами в процессе развития, в ходе деления клеток.
В новом теле

Вопрос о пересадке мозга, коль скоро мозг является вместилищем интеллекта и самого человеческого «я», по сути, не имеет смысла, так как если мозг уничтожен, то воссоздать личность невозможно (если только со временем не научатся делать «резервные копии» сознания). Единственное, что могло бы иметь резон - это пересадка головы, а точнее — пересадка тела голове, у которой с телом проблемы. Однако при невозможности на современном уровне медицины восстановления спинного мозга, тело с новой головой останется парализованным. Правда, по мере развития тканевой инженерии, возможно, нервную ткань спинного мозга можно будет восстанавливать с помощью стволовых клеток. На время операции мозг придется резко охлаждать для предотвращения смерти нейронов.
По запатентованной Сасаи методике японцам удалось вырастить трехмерные структуры нервной ткани, первой из которых стала полученная из эмбриональных стволовых клеток мышей сетчатка глаза (так называемый зрительный бокал), которая состояла из функционально различных типов клеток. Они были расположены так, как предписывает природа. Следующим достижением стал аденогипофиз, не просто повторяющий структуру природного, но и выделяющий при пересадке мыши необходимые гормоны.

Разумеется, до полнофункциональных имплантов нервной ткани, а тем более участков человеческого мозга еще очень и очень далеко. Однако успехи искусственной регенерации тканей с применением технологий эволюции развития указывают путь, по которому пойдет вся регенеративная медицина: от «умных» протезов — к композитным имплантатам, в которых готовые пространственные структуры «проращиваются» клеточным материалом, и далее — к выращиванию запасных частей для человека по тем же законам, по которым они развиваются в естественных условиях.
Современная медицинская техника позволяет заменять полностью или частично больные органы человека. Электронный водитель ритма сердца, усилитель звука для людей, страдающих глухотой, хрусталик из специальной пластмассы - вот только некоторые примеры использования техники в медицине. Все большее распространение получают также биопротезы, приводимые в движение миниатюрными блоками питания, которые реагируют на биотоки в организме человека.
Во время сложнейших операций, проводимых на сердце, легких или почках, неоценимую помощь медикам оказывают «Аппарат искусственного кровообращения», «Искусственное легкое», «Искусственное сердце», «Искусственная почка», которые принимают на себя функции оперируемых органов, позволяют на время приостановить их работу.
«Искусственное легкое» представляет собой пульсирующий насос, который подает воздух порциями с частотой 40-50 раз в минуту. Обычный поршень для этого не подходит, в ток воздуха могут попасть частички материала его трущихся частей или уплотнителя. Здесь, и в других подобных устройствах используют мехи из гофрированного металла или пластика - сильфоны. Очищенный и доведенный до требуемой температуры воздух подается непосредственно в бронхи.
«Аппарат искусственного кровообращения» устроен аналогично. Его шланги подключаются к кровеносным сосудам хирургическим путем. Первая попытка замещения функции сердца механическим аналогом была сделана еще в 1812 году. Однако до сих пор среди множества изготовленных аппаратов нет полностью удовлетворяющего врачей.
Отечественные ученые и конструкторы разработали ряд моделей под общим названием «Поиск». Это четырехкамерный протез сердца с желудочками мешотчатого типа, предназначенный для имплантации в ортотопическую позицию.
В модели различают левую и правую половины, каждая из которых состоит из искусственного желудочка и искусственного предсердия. Составными элементами искусственного желудочка являются: корпус, рабочая камера, входной и выходной клапаны. Корпус желудочка изготавливается из силиконовой резины методом наслоения. Матрица погружается в жидкий полимер, вынимается и высушивается - и так раз за разом, пока на поверхности матрицы не создается многослойная плоть сердца. Рабочая камера по форме аналогична корпусу. Ее изготавливали из латексной резины, а потом из силикона. Конструктивной особенностью рабочей камеры является различная толщина стенок, в которых различают активные и пассивные участки. Конструкция рассчитана таким образом, что даже при полном напряжении активных участков противоположные стенки рабочей поверхности камеры не соприкасаются между собой, чем устраняется травма форменных элементов крови.
 Российский конструктор Александр Дробышев, несмотря на все трудности, продолжает создавать новые современные конструкции «Поиска», которые будут значительно дешевле зарубежных образцов.
Российский конструктор Александр Дробышев, несмотря на все трудности, продолжает создавать новые современные конструкции «Поиска», которые будут значительно дешевле зарубежных образцов.
Одна из лучших на сегодня зарубежных систем «Искусственное сердце» «Новакор» стоит 400 тысяч долларов. С ней можно целый год дома ждать операции. В кейсе-чемоданчике «Новакора» находятся два пластмассовых желудочка. На отдельной тележке наружный сервис компьютер управления, монитор контроля, который остается в клинике на глазах у врачей. Дома, с больным блок питания, аккумуляторные батареи, которые сменяются и подзаряжаются от сети. Задача больного - следить за зеленым индикатором ламп, показывающих заряд аккумуляторов.
Аппараты «Искусственная почка» работают уже довольно давно и успешно применяются медиками. Еще в 1837 году, изучая процессы движения растворов через полупроницаемые мембраны, Т. Грехен впервые применил и ввел в употребление термин «диализ» (от греческого dialisis - отделение). Но лишь в 1912 году на основе этого метода в США был сконструирован аппарат, с помощью которого его авторы проводили в эксперименте удаление салицилатов из крови животных. В аппарате, названном ими «искусственная почка», в качестве полупроницаемой мембраны были использованы трубочки из коллодия, по которым текла кровь животного, а снаружи они омывались изотоническим раствором хлорида натрия. Впрочем, коллодий, примененный Дж. Абелем, оказался довольно хрупким материалом и в дальнейшем другие авторы для диализа пробовали иные материалы, такие как кишечник птиц, плавательный пузырь рыб, брюшину телят, тростник, бумагу…
Для предотвращения свертывания крови использовали гирудин - полипептид, содержащийся в секрете слюнных желез медицинской пиявки. Эти два открытия и явились прототипом всех последующих разработок в области внепочечного очищения.
Каковы бы не были усовершенствования в этой области, принцип пока остается одним и тем же. В любом варианте «искусственная почка» включает в себя полупроницаемую мембрану, с одной стороны которой течет кровь, а с другой стороны - солевой раствор. Для предотвращения свертывания крови используют антикоагулянты - лекарственные вещества, уменьшающие свертываемость крови. В этом случае происходит выравнивание концентраций низкомолекулярных соединений ионов, мочевины, креатинина, глюкозы, других веществ с малой молекулярной массой. При увеличении пористости мембраны возникает перемещение веществ с большей молекулярной массой. Если же к этому процессу добавить избыточное гидростатическое давление со стороны крови или отрицательное давление со стороны омывающего раствора, то процесс переноса будет сопровождаться и перемещением воды - конвекционный массообмен. Для переноса воды можно воспользоваться и осмотическим давлением, добавляя в диализат осмотически активные вещества. Чаще всего с этой целью использовали глюкозу, реже фруктозу и другие сахара и еще реже продукты иного химического происхождения. При этом, вводя глюкозу в больших количествах, можно получить действительно выраженный дегидратационный эффект, однако повышение концентрации глюкозы в диализате выше некоторых значений не рекомендуется из-за возможности развития осложнений. Наконец, можно вообще отказаться от омывающего мембрану раствора (диализата) и получить выход через мембрану жидкой части крови вода и вещества с молекулярной массой широкого диапазона.
В 1925 году Дж. Хаас провел первый диализ у человека, а в 1928 году он же использовал гепарин, поскольку длительное применение гирудина было связано с токсическими эффектами, да и само его воздействие на свертывание крови было нестабильным. Впервые же гепарин был применен для диализа в 1926 году в эксперименте X. Нехельсом и Р. Лимом.
Поскольку перечисленные выше материалы оказывались малопригодными в качестве основы для создания полупроницаемых мембран, продолжался поиск других материалов. И в 1938 году впервые для гемодиализа был применен целлофан, который в последующие годы длительное время оставался основным сырьем для производства полупроницаемых мембран.
Первый же аппарат «искусственная почка», пригодный для широкого клинического применения, был создан в 1943 году В.Колффом и X.Берком. Затем эти аппараты усовершенствовались. При этом развитие технической мысли в этой области вначале касалось в большей степени именно модификации диализаторов и лишь в последние годы стало затрагивать в значительной мере собственно аппараты. В результате появилось два основных типа диализатора. Так называемых катушечных, где использовали трубки из целлофана, и плоскопараллельных, в которых применялись плоские мембраны.
В 1960 году Ф.Киил сконструировал весьма удачный вариант плоскопараллельного диализатора с пластинами из полипропилена, и в течение ряда лет этот тип диализатора и его модификации распространились по всему миру, заняв ведущее место среди всех других видов диализаторов. Затем процесс создания более эффективных гемодиализаторов и упрощения техники гемодиализа развивался в двух основных направлениях. Конструирование самого диализатора, причем доминирующее положение со временем заняли диализаторы однократного применения, и использование в качестве полупроницаемой мембраны новых материалов. Диализатор - сердце «искусственной почки», и поэтому основные усилия химиков и инженеров были всегда направлены на совершенствование именно этого звена в сложной системе аппарата в целом. Однако, техническая мысль не оставляла без внимания и аппарат как таковой.
В 1960-х годах возникла идея применения так называемых центральных систем, то есть аппаратов «искусственная почка», в которых диализат готовили из концентрата - смеси солей, концентрация которых в 30-34 раза превышала концентрацию их в крови больного.
Комбинация диализа «на слив» и техники рециркуляции была использована в ряде аппаратов «искусственная почка», например американской фирмой «Travenol». В этом случае около 8 литров диализата с большой скоростью циркулировало в отдельной емкости, в которую был помещен диализатор, и в которую каждую минуту добавляли по 250 миллилитров свежего раствора и столько же выбрасывали в канализацию.
На первых порах для гемодиализа использовали простую водопроводную воду, потом из-за ее загрязненности, в частности микроорганизмами, пробовали применять дистиллированную воду, но это оказалось очень дорогим и малопроизводительным делом. Радикально вопрос был решен после создания специальных систем по подготовке водопроводной воды, куда входят фильтры для ее очистки от механических загрязнений, железа и его окислов, кремния и других элементов, ионообменные смолы для устранения жесткости воды и установки так называемого «обратного» осмоса.
Много усилий было затрачено на совершенствование мониторных систем аппаратов «искусственная почка». Так, кроме постоянного слежения за температурой диализата, стали постоянно наблюдать с помощью специальных датчиков и за химическим составом диализата, ориентируясь на общую электропроводность диализата, которая меняется при снижении концентрации солей и повышается при увеличении таковой. После этого в аппаратах «искусственная почка» стали применять ионо-селективные проточные датчики, которые постоянно следили бы за ионной концентрацией. Компьютер же позволил управлять процессом, вводя из дополнительных емкостей недостающие элементы, или менять их соотношение, используя принцип обратной связи.
Величина ультрафильтрации в ходе диализа зависит не только от качества мембраны, во всех случаях решающим фактором является трансмембранное давление. Поэтому в мониторах стали широко применять датчики давления: степень разрежения по диализату, величина давления на входе и выходе диализатора. Современная техника, использующая компьютеры, позволяет программировать процесс ультрафильтрации. Выходя из диализатора, кровь попадает в вену больного через воздушную ловушку, что позволяет судить на глаз о приблизительной величине кровотока, склонности крови к свертыванию. Для предупреждения воздушной эмболии эти ловушки снабжают воздуховодами, с помощью которых регулируют в них уровень крови. В настоящее время во многих аппаратах на воздушные ловушки надевают ультразвуковые или фотоэлектрические детекторы, которые автоматически перекрывают венозную магистраль при падении в ловушке уровня крови ниже заданного.
Недавно ученые создали приборы, помогающие людям, потерявшим зрение - полностью или частично.
Чудо-очки, например, разработаны в научно-внедренческой производственной фирме «Реабилитация» на основе технологий, использовавшихся ранее лишь в военном деле. Подобно ночному прицелу, прибор действует по принципу инфракрасной локации. Черно-матовые стекла очков на самом деле представляют собой пластины из оргстекла, между которыми заключено миниатюрное локационное устройство. Весь локатор вместе с очковой оправой весит порядка 50 граммов - примерно столько же, сколько и обыкновенные очки. И подбирают их, как и очки для зрячих, строго индивидуально, чтобы было и удобно, и красиво. «Линзы» не только выполняют свои прямые функции, но и прикрывают дефекты глаз. Из двух десятков вариантов каждый может выбрать для себя наиболее подходящий. Пользоваться очками совсем не трудно: надо надеть их и включить питание. Источником энергии для них служит плоский аккумулятор размерами с сигаретную пачку. Здесь же, в блоке, помещается и генератор. Излучаемые им сигналы, натолкнувшись на преграду, возвращаются назад и улавливаются «линзами-приемниками». Принятые импульсы усиливаются, сравниваются с пороговым сигналом, и, если есть преграда, тотчас звучит зуммер - тем громче, чем ближе подошел к ней человек. Дальность действия прибора можно регулировать, используя один из двух диапазонов.
Работы по созданию электронной сетчатки успешно ведутся американскими специалистами НАСА и Главного центра при университете Джона Гопкинса.
На первых порах они постарались помочь людям, у которых еще сохранились кое-какие остатки зрения. «Для них созданы телеочки, - пишут в журнале «Юный техник» С. Григорьев и Е. Рогов, - где вместо линз установлены миниатюрные телеэкраны. Столь же миниатюрные видеокамеры, расположенные на оправе, пересылают в изображение все, что попадает в поле зрения обычного человека. Однако для слабовидящего картина еще и дешифруется с помощью встроенного компьютера. Такой прибор особых чудес не создает и слепых зрячими не делает - считают специалисты, но позволит максимально использовать еще оставшиеся у человека зрительные способности, облегчит ориентацию.
Например, если у человека осталась хотя бы часть сетчатки, компьютер «расщепит» изображение таким образом, чтобы человек мог видеть окружающее хотя бы с помощью сохранившихся периферийных участков.
По оценкам разработчиков, подобные системы помогут примерно 2,5 миллионов людей, страдающих дефектами зрения. Ну а как быть с теми, у кого сетчатка практически полностью утрачена? Для них ученые глазного центра, работающего при университете Дюка (штат Северная Каролина), осваивают операции по вживлению электронной сетчатки. Под кожу имплантируются специальные электроды, которые, будучи соединены с нервами, передают изображение в мозг. Слепой видит картину, состоящую из отдельных светящихся точек, очень похожую на демонстрационное табло, что устанавливают на стадионах, вокзалах и в аэропортах. Изображение на «табло» опять-таки создают миниатюрные телекамеры, укрепленные на очковой оправе».
И, наконец, последнее слово науки на сегодняшний день - попытка методами современной микротехнологии создать новые чувствительные центры на поврежденной сетчатке. Такими операциями занимаются сейчас в Северной Каролине профессор Рост Пропет и его коллеги. Совместно со специалистами НАСА они создали первые образцы субэлектронной сетчатки, которая непосредственно имплантируется в глаз.
«Наши пациенты, конечно, никогда не смогут любоваться полотнами Рембрандта, - комментирует профессор. - Однако различать, где дверь, а где окно, дорожные знаки и вывески они все-таки будут.. »
Сотрудники лучшего частного детективного агентства в Москве профессионально решат ваши вопросы.
Спецпроект о проблемах старения мы продолжим рассказом о самых выдающихся и знаменитых исследователях, положивших начало работам по созданию искусственных органов. Большинство из них и сейчас продолжает работу над новыми амбициозными проектами.
Цикл статей, задуманных в рамках спецпроекта «биомолекулы» для фонда «Наука за продление жизни ».
В этом цикле рассмотрим общие проблемы старения клеток и организмов, научные подходы к долголетию и продлению здоровой жизни, связь сна и старения, питания и продолжительности жизни (обратимся к нутригеномике), расскажем про организмы с пренебрежимым старением , осветим темы (эпи)генетики старения и анабиоза.
Конечно, феномен старения настолько сложен, что пока рано говорить о радикальных успехах в борьбе с ним и даже о четком понимании его причин и механизмов. Но мы постараемся подобрать наиболее интересную и серьёзную информацию о нащупанных связях, модельных объектах, разрабатываемых и уже доступных технологиях коррекции возрастзависимых нарушений.
Следите за обновлениями!
Линда Гриффит и Чарльз Ваканти
Линда Гриффит - профессор биоинженерии и механической инженерии . В 2006 году получила стипендию Мак-Артура, также известную как «грант для гениев». Соавтор пионерской работы по выращиванию хряща в форме человеческого уха. На данный момент развивает технологии культивации 3D-культур клеток, а также участвует в проекте «Человек на чипе».
Чарльз Ваканти - профессор медицинской школы Гарварда . Соавтор пионерских работ по выращиванию хряща в форме человеческого уха, а также первой искусственной кости анатомической формы (для пациента с травмой большого пальца). Убежден в существовании способа переключения специализированных клеток в состояние стволовых, не использующего генетические модификации. Его убежденность не поколебал даже скандал с его бывшей аспиранткой, Харуко Обоката, сфабриковавшей результаты эксперимента по получению стволовых клеток. Чарльз Ваканти до последнего момента утверждал, что протоколы Харуко Обоката должны работать. В сентябре прошлого года, после того, как фальсификация данных японской исследовательницей была доказана, ушел в годовой академический отпуск. Судя по всему, после его окончания Чарльз Ваканти планирует продолжать поиски простого способа получения стволовых клеток.
В конце 1990-х годов по интернету разошлась жуткая картинка - мышь с человеческим ухом на спине (рис. 1). Картинку рассылали в основном по электронной почте, и подписи к ней со временем терялись. Многие люди не верили, что картинка настоящая, а другие начинали активно протестовать против генетической инженерии, в результате которой, по мнению этих людей, уродливая мышь появилась на свет. Картинка была настоящей. Человеческое ухо на спине у мыши вырастили, разумеется, без применения генетических модификаций (уже в те времена было понятно, что органы формируются при сложном взаимодействии многофункциональных генов, и никакого «гена человеческого уха» существовать не может). А работа, для которой была получена несчастная мышь, была одной из пионерских в области инженерии искусственных органов человека .

Рисунок 1. Знаменитая фотография из работы, сделанной в 90-х годах. Животное, вопреки предположениям многих напуганных людей, не подвергалось генетическим модификациям, а всего лишь служило средой, в которой синтетическая основа уха заселялась нанесёнными на нее клетками. Биореакторов, более подходящих для инкубации искусственного органа, в то время просто не существовало.
Ухо, по правде говоря, было человеческим лишь по форме, а составляющие его клетки были взяты у теленка. Тем не менее авторы работы, в числе которых были Линда Гриффит и Чарльз Ваканти, сделали первый шаг к созданию таких пугающе сложных структур как человеческие органы. Донорских органов настолько мало, и с ними так много проблем (и иммунологических, и психологических), что робость перед созданием искусственных частей человеческого тела было просто необходимо преодолеть.
Стратегия, которую применили Линда Гриффит и Чарльз Ваканти, до сих пор популярна в биоинженерии искусственных органов со сложной структурой. Сначала получают каркас из деградируемого полимера, а потом заселяют его клетками, которые постепенно разъедают каркас, делятся и осваивают освободившееся пространство. В менее «чистом» варианте того же метода используют основы органов, полученные от других животных или доноров, уничтожают их клетки, и заселяют полученный матрикс клетками реципиента. Такой орган нельзя считать полностью искусственным, и все же, он лучше донорского, так как не содержит его клеток и не вызывает отторжения иммунной системой. Такой вариант метода применяют, когда каркас сложно получить искусственно из-за его сложной структуры или состава и когда этот каркас должен войти в состав получившегося органа, а не разъедаться в процессе заселения клетками.
Заселение каркаса должно происходить в условиях, максимально приближенных к условиям внутри организма - с правильной температурой и течением питательных растворов через его части. Сейчас для этого используют специальные реакторы, которые приходится настраивать на форму определенного органа. А в первых работах 90-х годов в качестве биореакторов использовали мышей и крыс, которым заселенные клетками основы органов просто вживляли под кожу. Выглядели такие животные пугающе, зато цель - первые искусственные хрящи в форме человеческого уха - была достигнута.
Линда Гриффит продолжила работу в области инженерии искусственных тканей. Сейчас под ее руководством в специальном биореакторе поддерживают трехмерную культуру клеток печени. Такой культуре далеко до искусственной печени - она не похожа на нее по структуре, но тем не менее подходит для исследований лекарств и метаболизма гепатоцитов в условиях, близких к природным. Занимается исследовательница и разработкой органов на чипах, которые изобрел в 2010 году Дональд Ингбер (о нем речь пойдет позже).
Чарльз Ваканти заинтересовался другой стороной вопроса о выращивании искусственных органов - исследованиями стволовых клеток. Дело в том, что клетки, необходимые для выращивания нового органа, не всегда удобно (если вообще возможно) брать у донора. Поэтому, прежде чем учиться выращивать из подходящих клеток сложные структуры, сначала разумнее научиться получать эти подходящие клетки. Чарльза Ваканти интересовало преобразование клеток, которые легко взять у донора (например, с поверхности кожи), в клетки требуемого типа. Для этого нужно было научиться превращать специализированные клетки в стволовые - то есть способные приобрести любую специализацию. И, конечно, для биоинженеров важно, чтобы способ перепрограммирования клеток был не слишком сложным, иначе выгоды от его применения сойдут на нет. Чарльз Ваканти был убежден, что у организма должен быть способ переключать клетки в стволовое состояние , если это необходимо, - такая способность казалась ему слишком выгодной.
Возможно, решение кроется в ИПСК - индуцированных плюрипотентных стволовых клетках, которые можно получать из клеток различной специализации. О проблемах их получения и рисках использования читайте в статьях «В поисках клеток для ИПСК - шаг за шагом к медицине будущего » и «Предохранитель ИПСК » , .
Организму могут понадобиться стволовые клетки, если он испытывает сильный стресс, поэтому Чарльз Ваканти считал, что именно стресс может заставить клетки переключиться в стволовое состояние. Убедительных доказательств этой гипотезы ученому найти не удавалось. Зато ему удалось заинтересовать своими идеями японскую аспирантку Харуко Обоката . Поработав в лаборатории Ваканти в Гарварде, молодая исследовательница вернулась в институт RIKEN , где продолжила искать тот самый тип стресса, который заставит специализированные клетки стать стволовыми. Через Харуко Обоката история Чарльза Ваканти переплелась с судьбой еще одного выдающегося биоинженера - Ёсики Сасаи.
Ёсики Сасаи
Ёсики Сасаи - выдающийся биоинженер, пионер в области получения мини-органоидов методом воспроизведения первых этапов эмбрионального развития человека. Воспроизвел начальные этапы развития коры головного мозга, а также глазного бокала и гипофиза зародыша. В его лаборатории молодая исследовательница Харуко Обоката вела поиски простого метода превращения специализированных клеток в стволовые. Данные об успехе ее исследований Харуко Обоката сфабриковала. Устав от внимания прессы и обвинений научной общественности в недостаточном контроле за ходом работ под его руководством, Ёсики Сасаи в августе 2014 года повесился на перилах лестницы своего института .
Все живые организмы проходят долгий и трудный путь развития, прежде чем приобретают окончательную, зачастую очень сложную структуру. Если мы хотим получить копию искусственного органа, стоит вспомнить, как именно этот орган образуется в природе. Воспроизведение эмбрионального развития органа - очень перспективный путь для биоинженеров. Работами именно в этой области и прославился Ёсики Сасаи. В 2008 году были опубликованы результаты работы по воспроизведению первых этапов развития ни много ни мало человеческого мозга . А в 2011 году японские исследователи под руководством Сасаи получили зачатки гипофиза и глазных бокалов (рис. 2) . «В пробирке» (точнее, на чашке Петри) удается вырастить только мини-органоиды, потому что дальнейшие этапы их развития требуют сложного трехмерного окружения, которое, в свою очередь, тоже должно развиваться с ростом органа. Тем не менее, подбор условий, стимулирующих клетки повторять хотя бы первые стадии развития органа, уже дает много полезных данных для эмбриологии. Кроме того, на мини-органоидах, выращенных из клеток с генетическими мутациями, можно проследить становление патологии. И конечно, мини-органоиды подходят для тестирования лекарств и особенно для изучения их влияния на ранние стадии развития организма.
К несчастью для Ёсики Сасаи, под его руководством шли работы и на другие темы. В начале 2014 года в журнале Nature была опубликована статья, первым автором которой была Харуко Обоката, а последним - Ёсики Сасаи. В статье был описан на удивление простой метод перепрограммирования специализированных клеток в стволовые - с помощью непродолжительной инкубации в растворе лимонной кислоты. Стволовые клетки, полученные таким способом, назвали STAP (stimulus-triggered acquisition of pluripotency ). STAP-клетки могли бы вызвать настоящую революцию в регенеративной медицине - таким простым методом, как описали японские ученые, стволовые клетки можно было бы получать в огромных количествах. К сожалению, никаким другим исследователям, кроме Харуко Обоката, получить STAP-клетки не удалось. На японских ученых посыпались вопросы от разочарованных коллег и прессы, и Харуко Обоката пришлось повторить эксперименты в собственной лаборатории, чтобы доказать, что метод может работать. Ей это не удалось. В ходе расследования под эгидой института RIKEN выяснилось, что Харуко Обоката подтасовала данные скандальной публикации, а руководитель исследования - Ёсики Сасаи - об этом не знал. В августе 2014 ученый, тяжело переживавший скандал вокруг исследования, покончил жизнь самоубийством. Харуко Обоката не стала оспаривать решение экспертной комиссии о подтасовке результатов.
Интересно, что в ходе скандала Чарльз Ваканти (бывший руководитель Харуко Обоката) активно выступал в защиту японских ученых. В конце концов ему пришлось признать, что статья была отозвана обоснованно, но, несмотря на это, он не отказался от своей любимой идеи о возможности получить стволовые клетки из специализированных без трудоемких генетических модификаций. В сентябре прошлого года Чарльз Ваканти ушел в годовой академический отпуск, который к настоящему моменту как раз закончился.
Неизвестно, будет ли найден однажды простой способ получения стволовых клеток. Как бы то ни было, другое направление исследований Ёсики Сасаи - получение органоидов - оказалось очень плодотворным. В последующие годы ученым разных групп удалось получить мини-органоиды кишечника, желудка и почек . Последнее достижение в этой области - органоиды сердца - принадлежит знаменитому специалисту по созданию искусственных органов Энтони Атала .
Энтони Атала
Энтони Атала - директор . Научился получать из собственных клеток пациентов искусственный мочевой пузырь, уретру и влагалище. Сейчас во всем мире живут десятки людей с такими искусственными органами, созданными под руководством Энтони Атала. Сейчас знаменитый биоинженер работает над созданием искусственного пениса, который подошел бы жертвам несчастных случаев и мужчинам с врожденными патологиями репродуктивной системы.
Энтони Атала - директор целого института регенеративной медицины. Под руководством ученого в этой области было сделано много замечательных работ, все более и более сложных. В основном Энтони Атала занимается созданием искусственных органов мочеполовой системы. Начал он с самого простого - мочевого пузыря . По сути дела, мочевой пузырь - это просто мешок из клеток, и операции, в которых мочевые пузыри делают из тканей кишечника, проводятся уже довольно давно. Конечно, у этих органов очень разные функции - стенки кишечника всасывают питательные вещества, а мочевой пузырь просто служит резервуаром для мочи перед ее выведением. Поэтому, конечно, хотелось научиться получать этот несложный орган из более подходящего материала. Энтони Атала использовал для этого уже упомянутый метод - выращивание клеток на специальном каркасе анатомической формы. Такие искусственные мочевые пузыри вживили нескольким мальчикам с патологиями этого органа в 1999 году. Спустя 5 лет наблюдений Энтони Атала с коллегами доложили, что искусственные органы прижились хорошо, и не вызвали осложнений у реципиентов . После этого ученый перешел к более сложной задаче - созданию искусственных влагалищ. В отличие от мочевых пузырей, эти органы никогда не пытались получить искусственно. В то же время, устройство влагалища тоже не очень сложное - это трубка из клеток. В 2005-2009 годах четырем девочкам с редкими патологиями, при которых половая система развивается неправильно, были вживлены такие искусственные влагалища. В 2014 году ученый доложил об успехе всех операций, благодаря которым подросшие пациентки смогли жить нормальной половой жизнью . Параллельно ученые под руководством Энтони Атала научились получать другой орган трубчатой структуры - уретру (мочеиспускательный канал) . Такие искусственные органы вживили пяти мальчикам, и операции также прошли успешно и не вызвали осложнений.
На очереди оказался самый сложный орган мочеполовой системы - пенис. Современная хирургия уже позволяет пришивать пациентам, потерявшим пенис из-за несчастных случаев, орган донора. Первая такая операция была проведена еще в 2006 году. Однако спустя две недели после этой сложнейшей операции пациент попросил удалить донорский пенис . Такое решение кажется странным лишь на первый взгляд. Пенис относится к органам, которые жертвуют лишь посмертно, а привыкнуть к жизни с пенисом умершего человека явно сложнее, чем к жизни с донорской почкой. От первой в мире пересаженной руки, к примеру, реципиент также отказался вскоре после операции . Так что инженерия наружных органов - вопрос, в определенном смысле, даже более срочный, чем инженерия жизненно важных частей тела. Ведь, пока хирургам в качестве материала предоставляют только донорские органы, многие сложнейшие операции будут проходить напрасно. К тому же, помимо психологических проблем, с донорскими органами возникают еще и проблемы иммунологической совместимости - пациентам часто приходится принимать препараты, подавляющие деятельности иммунной системы, чтобы она не начинала атаковать чужеродную часть тела.
Пенис сконструировать намного труднее, чем просто пузырь или трубку из клеток, ведь для функционирования этого органа необходима правильная структура во всем его объеме. Совершенно необходимо воспроизвести губчатую ткань пещеристых тел, которые разбухают при эрекции, а также структуру сосудов, по которым к этой ткани поступает кровь. И, само собой, нужно разместить в нем уретру, которая не должна пережиматься при набухании пещеристых тел. С нуля воспроизвести такую структуру очень сложно, поэтому Энтони Атала использует для получения искусственных пенисов коллагеновые основы донорских органов, которые очищают от клеток с помощью ферментов. Потом ее заселяют клетками человека, которому орган впоследствии можно будет без проблем пересадить (пока такие операции не проводили). По словам Энтони Атала, какой бы тяжелой не была травма пениса, благодаря тому, что этот орган продолжается и внутри таза, у человека всегда можно взять клетки на выращивание нового .
Человеческие искусственные пенисы пока в разработке - чтобы их можно было пересаживать реципиентам, они должны пройти много сложных тестов. Зато уже есть успешные результаты для кроликов - животные с пенисами, полученными методом Энтони Атала, успешно спариваются и обзаводятся потомством. Однако перейти от кроликов к людям оказалось не так просто - чтобы получить орган большего размера, недостаточно просто пропорционально увеличить количество клеток, время инкубации и прочие параметры. К тому же с увеличением объема органа становятся выше и требования к его внутренней структуре - ведь каждая клетка живого организма должна находиться от ближайшего капилляра на расстоянии не больше 200 микрометров (что примерно равно толщине человеческого волоса). Поэтому вырастить крупный объемный орган всегда сложнее, чем плоский (как фрагмент кожи), трубчатый (как искусственная уретра) или мешковидный (как мочевой пузырь).
Интересы Энтони Атала не ограничиваются мочеполовой системой. В его лаборатории идут работы по получению искусственных тканей печени, сердца и легких. В 2011 году во время конференции TED знаменитый ученый взбудоражил общественность, продемонстрировав полученный методом 3D-печати прототип искусственной почки . Ключевым словом, на которое многие не обратили внимания, было «прототип» - искусственная почка имела правильную форму, а также доказывала, что с помощью 3D-печати можно получить нечто, хотя бы внешне сходное с желаемым объектом. Но структура прототипа почки даже близко не приближалась к сложности настоящего органа, которая совершенно необходима, чтобы почка выполняла свою функцию. Этот орган должен состоять из тончайших канальцев, опутанных сосудами, для того, чтобы выделять с мочой только ненужные вещества, а все полезное возвращать в кровь. К такой сложности биоинженерам до сих пор не удалось подойти, и, конечно, ее невозможно было достичь в 2011 году. Однако, по-видимому, именно метод биопечати со временем позволит ученым получать точно те биологические структуры, которые ему необходимы. Этот метод разработал и активно развивает еще один знаменитый биоинженер - Габор Форгач.
Габор Форгач
Габор Форгач - знаменитый биоинженер и предприниматель от науки. Под его руководством был создан первый коммерческий 3D-биопринтер, на котором уже напечатаны образцы многих тканей. Вместе со своим сыном Андрасом основал компанию Modern Meadow , производящую искусственную кожу и искусственное мясо для употребления в пищу.
В 1996 году Габор Форгач обратил внимание на факт, уже давно известный ученым -клетки, образовавшиеся в ходе деления зародыша, могут двигаться по нему, но, попав в окончательное место назначения, склеиваются с другими клетками. Это навело его на мысль, что клетки можно использовать в качестве элементарных единиц для конструирования - если подобрать правильные условия, то клетки, уложенные в желаемые структуры, сами склеятся между собой. Однако, идея о том, что для такого укладывания клеток можно применять специальный принтер, ему в голову не пришла.
Первым додумался печатать биологические объекты Томас Боланд . Он модифицировал обычный принтер таким образом, что на нем стало возможным печатать биологическими материалами, например, белками или бактериями. Для 3D-печати прибор не подходил. Идея, тем не менее, оказалась здравой, и со временем привела к разработке биопринтеров, способных печатать сложные объемные структуры.
Форгачу потребовалось много времени, чтобы развить свою идею о самостоятельном склеивании клеток в технологию получения трехмерных искусственных тканей. Несколько лет потребовалось и на разработку принтера, способного применить эту технологию. Устройство должно было стать достаточно точным и деликатным по отношению к чувствительным клеточным «чернилам». Такой прибор под названием Organovo компании Форгача удалось создать только в 2009 году . В 2010 году на этом первом биопринтере напечатали человеческий сосуд, и, что с самого начала было важно для Форгача, без всяких дополнительных каркасов. Благодаря этому появляется уверенность, что в органе не будет содержаться абсолютно ничего, вызывающего иммунологическое отторжение у реципиента (если орган выращивать из его собственных клеток).
Чтобы сделать из клеток аналог чернил принтера, их помещают в специальный гель, который не позволяет клеткам слипаться раньше времени. Принтер печатает, как правило, не единичными клетками, а их шарообразными скоплениями - сфероидами (хотя метод позволяет использовать для печати и отдельные клетки, что необходимо для некоторых структур), идея которых также принадлежит Габору Форгачу . Каждый напечатанный слой клеток отделяют слоем геля, а уже готовый орган отправляют дозревать в инкубатор. При этом гель, использованный для печати, растворяется, а внутри органа развивается его сосудистая сеть - от сосудов отрастают тончайшие капилляры. Это очень удобно для биоинженеров, потому что получать такие мелкие сосуды они пока не умеют. Кроме того, если орган пересадить реципиенту, то в новую часть тела обязательно проникнет сосудистая сеть хозяина. Однако такая практика скорее подходит для животных, а не для человека - в его случае слишком опасно полагаться на то, что нужные сосуды врастут в орган сами. К тому же надеяться на то, что сосуды сами вырастут как нужно, совершенно точно нельзя в случае органов со сложной структурой - таких, как уже обсуждавшиеся почки. Так что остается надеяться на повышение точности 3D-печати в будущем.
3D-биопечать продолжает развиваться уже во всем мире: в 2010 году впервые удалось напечатать фрагмент кожи , а в 2014 - сердечный клапан (рис. 3) и фрагмент ткани печени . Такие ткани прекрасно подходят для предварительных испытаний прототипов лекарственных препаратов, а кожа - еще и для тестов косметических средств (компания L’Oreal, к примеру, уже использует для тестов искусственную кожу, напечатанную Organovo ). Такие тесты проще организовать, чем тесты на животных, которые требуют согласования с биоэтическими комиссиями. Кроме того, тесты на человеческих, пусть и выращенных в лаборатории, органах и коже, дают более достоверные результаты о влиянии продукта на человеческий организм, чем исследования на лабораторных животных.
О том, как в России развивается 3D-печать, рассказано в статье «Органы из лаборатории » .
Последнее достижение биопечати на данный момент - фрагмент нервной ткани человека с точно позиционированными нейронами, полученный в этом году под руководством австралийского биоинженера Гордона Уэлласа (тот самый случай, когда необходимо печатать ткань отдельными клетками, а не сфероидами) .
Габор Форгач не только положил начало 3D-печати органов человека для больных людей или переживших несчастный случай. Он еще и первым понял, что искусственные ткани и органы могут пригодиться всем людям без исключения. Некоторые продукты животного происхождения - такие как мясо и кожа - настолько хороши, что им трудно создать полноценную замену. Но теперь, благодаря биоинженерии, их можно будет получать этичным образом - без убийств животных. Габору Форгачу первому пришло в голову, что мы уже знаем достаточно для выращивания искусственного бифштекса или куска кожи. Получать их значительно проще, чем многие искусственные органы, над разработкой которых бьются ученые, а потребность в мясе и коже значительно выше, чем в человеческих органах. Также переход на мясо и кожу искусственного происхождения благоприятно сказался бы на экологической ситуации - ведь биореакторы не вытаптывают огромные пастбища и не выделяют в атмосферу такое количество метана, какое может существенно усилить парниковый эффект.
Поэтому вторая компания Форгача, которую он основал вместе со своим сыном Андрасом - Modern Meadow - выращивает мясо и кожу в лабораторных условиях . Важный аспект деятельности компании - это оптимизация методик, поскольку сейчас искусственные копии продуктов животного происхождения обходятся дороговато. Другая проблема состоит в том, что общественность с недоверием относится к выращенным в лаборатории продуктам. Согласно опросу, проведенному в 2014 году, лишь 20% американцев готово попробовать полученное лабораторными методами мясо . Поэтому сам Форгач старается доказать людям, что его продукты безопасны, в том числе на собственном примере. Например, в 2011 году на конференции TedMed Форгач собственноручно приготовил, а затем съел выращенное в лаборатории мясо . Кроме того, биоинженер уверяет, что его лаборатории открыты для потенциальных клиентов, и каждый может увидеть, как делается сосиска, в то время как «бойни никогда не приглашают посетителей понаблюдать за их работой» .
Габор Форгач уловил, что в биотехнологиях не хватает собственно технологичности - многие методы, использовавшиеся при попытках воспроизвести сложнейшую структуру органов, были старомодными по своей сути. Биология остается не очень точной наукой, но при создании искусственных органов для живых людей, по мнению Форгача, неприемлемо рассчитывать на то, что правильная структура образуется как-нибудь сама. 3D-биопринтеры следуют веяниям времени и воплощают в жизнь мечты о точном контроле над тем, что кажется полностью хаотичным и загадочным, - жизнью. И только одно направление биоинженерии, возможно, еще более технологично и футуристично - органы на чипах.
Дональд Ингбер
Дональд Ингбер - биолог, знаменитый своим инженерным взглядом на живые объекты, благодаря которому ученый сделал несколько открытий в области биологии клетки (например, о влиянии механических воздействий на активность генов). Автор идеи «органа на чипе» - простейшей клеточной системы, расположенной на пластинке стандартного размера и воспроизводящей основные функции моделируемого органа. Создал множество органов на чипах, и сейчас работает над объединением десяти таких органов в «человека на чипе».
До начала двухтысячных Дональд Ингбер исследовал биологию рака - параметры, влияющие на развитие опухолей и метастазирование раковых клеток. При этом ученый смотрел на живую клетку как инженер. На подход ученого к исследованиям клеточной биологии повлияла, как ни странно, одна необычная скульптура, которую Дональд Ингбер увидел в середине 70-х годов. Скульптура была сконструирована по принципу тенсегрити . Такие конструкции состоят из прочных балок, которые не касаются друг друга благодаря системе натянутых тросов. Вся структура поддерживается за счет точно сбалансированных натяжений гибких элементов. Дональд Ингбер предположил, что и структура живой клетки может поддерживаться благодаря тем же принципам. И действительно, ему удалось показать, например, что приложенные к поверхности клетки механические воздействия могут повлиять на форму ее ядра и даже на экспрессию генов. Глубокое понимание того, как механические силы влияют на структуру и функцию клеток, помогло ученому продвинуться в исследовании биологии рака .
Вероятно, такое стремление ввести исследования клетки в более понятную, «механическую» плоскость, в конце концов и привело Дональда Ингбера к идее органов на чипах. Орган на чипе - это пластинка размером не более кредитной карточки. В пластинке есть ячейки, заселенные клетками определенных типов. Ячейки соединяются каналами, имитирующими кровоток или обмен тканевой жидкости между группами клеток органа. Разумеется, такое устройство не отражает форму природного органа, но зато в максимально компактной и контролируемой форме моделирует саму суть его работы. Жизнедеятельность клеток в органе на чипе нужно поддерживать, помещая чип в специальный реактор, который прогоняет по каналам чипа питательные растворы под правильным давлением и поддерживает определенную температуру и содержание растворенных газов в этих жидкостях.
Важнейшее преимущество органов на чипах соответствует технологическим трендам: это модульность - возможность составлять из таких устройств разные комбинации. Чипы, изображающие различные органы, можно соединять между собой, чтобы изучать влияние этих органов друг на друга, моделировать передвижения болезнетворных микробов по различным системам организма или же изучать, что происходит с молекулами лекарства, когда оно попадает в организм.
Первое устройство такого типа - легкое на чипе - Дональд Ингбер с коллегами разработали в 2010 году . Каналы этого устройства разделены на две части пористой мембраной, с одной стороны которой располагается слой клеток легкого, а с другой - слой клеток стенки сосуда. В той части каналов, где располагались клетки сосуда, циркулирует кровь, а та, где находятся клетки легкого, заполнена воздухом. В обе части каналов ведут специальные отверстия - туда можно добавлять лекарства или, к примеру, болезнетворных микроорганизмов, чтобы смоделировать их попадание в легкое из воздуха или с током крови.
С тех пор на чипах удалось воспроизвести работу почки , печени , а также кишечника с микробиомом и перистальтикой (рис. 4) . Особенно интересной для клинических исследований оказалась разработка чипа, отражающего устройство гематоэнцефалического барьера . Разработчики воспроизвели и плотные контакты между клетками сосудов мозга, и расположение глиальных клеток - особенности, благодаря которым многие молекулы из крови не могут легко проникнуть в мозг. При тестировании прототипов лекарств очень полезно узнать, способны ли они проникать сквозь гематоэнцефалический барьер, и если да, то с какой эффективностью. Кроме этого, на чипе удалось воспроизвести устройство гематопоэтической ниши костного мозга, что крайне полезно для исследований болезней, при которых нарушается нормальное развитие клеток крови .

Рисунок 4. «Кишечник на чипе». а . Схема устройства. Гибкая пористая мембрана, выстланная эпителиальными клетками кишечника, расположена горизонтально по центру микроканала, по бокам которого находятся вакуумные камеры. б . Фотография «кишечника на чипе», состоящего из прозрачного ПДМС-эластомера (эластомера из полидиметилсилоксана). По направлению стрелок насосом заливают красную и синюю жидкости в нижний и верхний отсеки микроканала, соответственно, чтобы их визуализировать.
М.В.Плетников
перевод с английского Science, 1995,
Vol. 270, N 5234, pp. 230-232.
Создание искусственных органов и тканей оформилось в самостоятельную отрасль науки около десяти лет тому назад. Первые достижения этого направления - создание искусственной кожи и хрящевой ткани, образцы которых уже проходят первые клинические испытания в центрах трансплантации. Одно из последних достижений состоит в конструировании хрящевой ткани, способной к активной регенерации. Это действительно огромный успех, поскольку поврежденная суставная ткань не регенерирует в организме. В клиниках США ежегодно оперируют более 500 тыс. больных с повреждениями суставного хряща, но подобное хирургическое вмешательство лишь на короткое время облегчает боль и улучшает движения в суставе. Ученые из Гётеборгского университета в Швеции экстрагировали хондроциты (клетки хряща) из суставов 23 пациентов, вырастили культуру клеток, которая образовала хрящевую ткань, а затем имплантировали ее в поврежденный коленный сустав. Результат оказался превосходным: у 14 из 16 пациентов было отмечено практически полное замещение поврежденного хряща новой тканью в месте ее имплантации. Выращивание хрящевой ткани занимает, к сожалению, много времени - несколько недель, поэтому ученые пытаются разработать методики более быстрого получения искусственных тканей. Например, группа экспериментаторов из биотехнологической компании "Organogenesis
" провела выращивание пленки искусственной кожи на матриксе из природного коллагена, что позволяет практически сразу использовать эту новую ткань в клинике.
При клиническом испытании нового кожного трансплантата было показано, что он улучшает (не менее чем на 60% по сравнению с обычными материалами) заживление венозных язв и кожных повреждений. Однако кожа и хрящ - ткани, состоящие из одного или двух типов клеток, и требования к структуре основы, предназначенной для их выращивания в искусственных условиях, относительно невысоки. Со многими же другими органами дело обстоит гораздо сложнее. В настоящее время предпринимаются попытки выращивания в лабораторных условиях печени. Но печень - сложно устроенный орган, состоящий из разных типов клеток, обеспечивающих очищение крови от токсинов, преобразование поступивших извне питательных веществ в усваиваемую организмом форму и выполняющих целый ряд других функций. Поэтому создание искусственной печени требует гораздо более сложной технологии: все эти разнообразные типы клеток должны быть размещены строго определенным образом, то есть основа, на которой они базируются, должна обладать высокой избирательностью.
С этой целью на такую синтетическую основу наносятся молекулы, обладающие свойствами клеточной адгезии и межклеточного узнавания - функциями установления специфических межклеточных связей в организме. История создания такой подложки для клеток печени может служить иллюстрацией преимуществ комбинированной технологии.
Например, исследователям из Массачусетского технологического института удалось создать подложку, на которой закрепляются только клетки-гепатоциты. Хорошо известно, что клетки этого типа выполняют в организме больше метаболических функций, чем любые другие. Одной из таких функций является удаление из кровеносного русла поврежденных белков. Гепатоциты узнают эти белки по определенным углеводным последовательностям, которые и "маркируют" их как брак. Исследователи синтезировали молекулы с такой последовательностью звеньев и "прикрепили" их к искусственному полиакриламидному полимеру, полагая, что эти "приманки" будут избирательно "привлекать" гепатоциты. Действительно, гепатоциты узнавали метки и задерживались на поверхности полимера. Однако впоследствии оказалось, что полиакриламид не может служить подходящим материалом для искусственной печени, поскольку вызывает сильную иммунную реакцию со стороны организма. Необходимо было искать какой-то другой полимер, который бы не отторгался организмом, но при этом и не адсорбировал бы различные белки, которые, осев на полимере, тут же начинали бы привлекать все типы клеток без разбора. В конце концов старания ученых увенчались определенным успехом. Им удалось синтезировать сетчатую подложку из полиэтилен-оксида (ПЭО), не вызывающего иммунной реакции и не адсорбирующего белки. ПЭО представляет собой молекулу звездчатой формы, лучи которой расходятся в разные стороны от плотного центрального ядра. Когда молекулы ПЭО связываются между собой, концы лучей каждой "звезды" свободно плавают в водном растворе. При этом они несут на себе реактивные гидроксильные группы, к которым и прикрепляют углеводные "приманки" для гепатоцитов.
Было показано, что при добавлении в такой раствор гепатоцитов крысы они тут же связываются с углеводами и закрепляются на сетчатой подложке, в то время как фибробласты, внесенные в раствор, на полимере не оседают. Таким образом, ученым посчастливилось разрешить одну из самых больших проблем в создании искусственных органов: сконструировать высокоспецифический клеточный акцептор. Следующим этапом стало формирование трехмерной структуры сетчатой подложки. Здоровая печень состоит из массы клеток, пронизанных сложной сетью кровеносных сосудов. Для нормальной работы печени различные типы клеток должны быть расположены по отношению друг к другу в определенном порядке. Разработав способ укладки полимера (полиактиновой кислоты) на тончайшую бумажную основу под управлением компьютера, что позволяет в дальнейшем конструировать уже трехмерную архитектуру органа, исследователи теперь бьются над проблемой соединения с трехмерной структурой нового полимера молекул ПЭО, несущих "приманки". В будущем они надеются присоединить к полимеру и метки другого типа, например антитела, привлекающие к себе клетки, образующие желчные протоки. Наконец, предполагается использование аминокислот - глютаминовой, аспарагиновой и аргинина - для формирования специфического эндотелиального слоя печени. Так постепенно, шаг за шагом, ученые надеются создать полноценную искусственную печень. Гибридные основы-подложки хорошо зарекомендовали себя и в экспериментах по "выращиванию" нервных волокон. В этом случае в качестве подложки оказался особенно эффективен тефлон - материал, совершенно безвредный для организма. Соединение тефлоновой сетки с молекулами ламинина посредством модифицированных ионизированным газом атомов никеля представляет собой, по мнению исследователей, весьма перспективную основу, на которой может происходить рост отростков нервных клеток. Ламинин в данном случае выполняет функцию регуляции и направления роста нервов. Следующим шагом, приближающим клиническое применение индуцированного роста предназначенных для трансплантации нервов, должно стать изготовление специальных направляющих трубочек, которые можно было бы размещать в организме вдоль поврежденных нервных волокон. Тефлон также давно используют в искусственных кровеносных сосудах. Однако до сих пор из него производят только широкие (более 6 мм в диаметре) сосуды, так как сосуды меньшего диаметра через 1-2 года после имплантации закупориваются тромбоцитами и гладкомышечными клетками. Этого не происходило бы, если бы структура стенок имплантированного сосуда была похожа на выстилающий эпителий настоящих вен и артерий.
Проблему можно решить путем нанесения на полимер естественных эпителиальных клеток, образующих гладкую выстилку внутренних стенок сосудов, к которой не прилипают тромбоциты и гладкомышечные клетки. Создание такого искусственного эпителия и является основной проблемой конструирования кровеносных сосудов. К слову сказать, аналогичное налипание клеток, и как следствие, закупоривание сосудов, происходит и в самом организме из-за атеросклеротического изменения эпителия. При решении этой задачи, как и при попытках вызвать направленный рост нервных волокон, ученые пользуются "услугами" белков межклеточной адгезии и внеклеточного матрикса: фибронектина и ламинина. Среди органов и тканей, которые в настоящее время интенсивно исследуются с целью их биотехнологического воссоздания, можно отметить также костную ткань, сухожилия, кишечник, сердечные клапаны, костный мозг и трахею. Помимо работ по созданию искусственных органов и тканей человеческого организма ученые продолжают разрабатывать и методы вживления в организм больных диабетом людей клеток, продуцирующих инсулин, а людям, страдающим болезнью Паркинсона, - нервных клеток, синтезирующих нейромедиатор дофамин, что позволит избавить пациентов от ежедневных утомительных инъекций.
АО «Медицинский университет Астана»
Кафедра медбиофизики и ОБЖ
Реферат
На тему: Искусственные органы
Выполнила: Нурпеисова Д.
Группа:144 ОМ
Проверила: Масликова Е.И.
Астана 2015 год
Введение
Искусственная почка
Искусственное сердце
Искусственный кишечник
Искусственная кожа
Искусственная кровь
Искусственное лёгкое
Искусственные кости
Заключение
Введение
Быстрое развитие медицинских технологий и все более активное использование в них последних достижений смежных наук позволяют сегодня решать такие задачи, которые еще несколько лет назад казались невыполнимыми. В том числе - и в области создания искусственных органов, способных все более успешно заменять свои природные прототипы.
Причем самое удивительное в этом то, что подобные факты, еще несколько лет назад способные стать основой для сценария очередного голливудского блокбастера, сегодня привлекают внимание публики всего на несколько дней. Вывод вполне очевиден: не за горами тот день, когда даже самые фантастичные идеи относительно возможностей замены природных органов и систем их искусственными аналогами перестанут быть некой абстракцией. А значит, однажды могут появиться и люди, у которых подобных имплантов окажется больше, чем собственных частей тела.
Пересадка органов воплощает извечное стремление людей научиться "ремонтировать" человеческий организм.
. Искусственная почка
Один из самых необходимых искусственных органов - это почка. В настоящее время сотни тысяч людей в мире для того, чтобы жить, должны регулярно получать лечение гемодиализом. Беспрецедентная « машинная агрессия», необходимость соблюдать диету, принимать медикаменты, ограничивать прием жидкости, потеря работоспособности, свободы, комфорта и различные осложнения со стороны внутренних органов сопровождают эту терапию.В 1925 году Дж. Хаас провел первый диализ у человека, а в 1928 году он же использовал гепарин, поскольку длительное применение гирудина было связано с токсическими эффектами, да и само его воздействие на свертывание крови было нестабильным. Впервые же гепарин был применен для диализа в 1926 году в эксперименте Х. Нехельсом и Р. Лимом.
Поскольку перечисленные выше материалы оказывались малопригодными в качестве основы для создания полупроницаемых мембран, продолжался поиск других материалов, и в 1938 году впервые для гемодиализа был применен целлофан, который в последующие годы длительное время оставался основным сырьем для производства полупроницаемых мембран.
Первый же аппарат «искусственная почка», пригодный для широкого клинического применения, был создан в 1943 году В. Колффом и Х. Берком. Затем эти аппараты усовершенствовались. При этом развитие технической мысли в этой области вначале касалось в большей степени именно модификации диализаторов и лишь в последние годы стало затрагивать в значительной мере собственно аппараты.
В результате появилось два основных типа диализатора, так называемых катушечных, где использовали трубки из целлофана, и плоскопараллельных, в которых применялись плоские мембраны.
В 1960 году Ф. Киил сконструировал весьма удачный вариант плоскопараллельного диализатора с пластинами из полипропилена, и в течение ряда лет этот тип диализатора и его модификации распространились по всему миру, заняв ведущее место среди всех других видов диализаторов.
Затем процесс создания более эффективных гемодиализаторов и упрощения техники гемодиализа развивался в двух основных направлениях: конструирование самого диализатора, причем доминирующее положение со временем заняли диализаторы однократного применения, и использование в качестве полупроницаемой мембраны новых материалов.
Диализатор
- сердце «искусственной почки», и поэтому основные усилия химиков и инженеров были всегда направлены на совершенствование именно этого звена в сложной системе аппарата в целом. Однако техническая мысль не оставляла без внимания и аппарат как таковой.
В 1960-х годах возникла идея применения так называемых центральных систем, то есть аппаратов «искусственная почка», в которых диализат готовили из концентрата - смеси солей, концентрация которых в 30-34 раза превышала концентрацию их в крови больного. В 2010 году в США был разработан имплантируемый в организм больного гемодиализный аппарат. Аппарат, разработанный в Калифорнийском университете в Сан-Франциско имеет размеры в целом соответствующие размеру человеческой почки. Имплантат, помимо традиционной системы микрофильтров, содержит биореактор с культурой клеток почечных канальцев, способных выполнять метаболические функции почки. Прибор не требует энергообеспечения и работает за счёт давления крови пациента. Данный биореактор имитирует принцип работы почки за счёт того, что культура клеток почечных канальцев находится на полимерном носителе и обеспечивает обратную реабсорбцию воды и полезных веществ, так же как это происходит в норме. Это позволяет значительно повысить эффективность диализа и даже полностью отказаться от необходимости трансплантации донорской почки. Гемодиализатор
Иначе, искусственная почка - аппарат для временного замещения выделительной функции почек. Искусственную почку используют для освобождения крови от продуктов обмена, коррекции электролитно-водного и кислотно-щелочного балансов при острой и хронической почечной недостаточности, а также для выведения диализирующихся токсических веществ при отравлениях и избытка воды при отёках. Функция
Основная функция очищение крови от различных токсичных веществ, в том числе продуктов метаболизма. При этом объём крови в пределе организма остаётся постоянным.
2. Искусственное сердце
Сердце - полый мышечный орган. Его масса у взрослого человека составляет 250-300 грамм. Сокращаясь, сердце работает как насос, проталкивая кровь по сосудам и обеспечивая её непрерывное движение. При остановке сердца наступает смерть, потому что прекращается доставка тканям питательных веществ, а так же освобождение тканей от продуктов распада. От создания «сердца» до нашего времени.
Создателем искусственного сердца был В. П. Демихов еще в 1937 г. С течением времени это устройство претерпело колоссальные преобразования в размерах и способах использования Искусственное сердце - механический прибор, который временно берет на себя функцию кровообращения, в случае если сердце пациента не может полноценно обеспечивать организм достаточным количеством крови. Существенным его недостатком является потребность в постоянной подзарядке от электросети. В 2009 году еще не было создано эффективного имплантируемого человеку протеза всего сердца. Ряд ведущих кардиохирургических клиник проводит успешные частичные замены органических компонентов на искусственные. По состоянию на 2010 год существуют прототипы эффективных имплантируемый искусственно человеку протезов всего сердца. искусственный протез имплантируемый
В настоящее время протез сердца рассматриваются как временная мера позволяющая пациенту с тяжелой сердечной патологией дожить до момента пересадки сердца. Модель сердца.
Отечественные ученые и конструкторы разработали ряд моделей под общим названием «Поиск». Это четырехкамерный протез сердца с желудочками мешотчатого типа, предназначенный для имплантации в ортотопическую позицию. В модели различают левую и правую половины, каждая из которых состоит из искусственного желудочка и искусственного предсердия. Составными элементами искусственного желудочка являются: корпус, рабочая камера, входной и выходной клапаны. Корпус желудочка изготавливается из силиконовой резины методом наслоения. Матрица погружается в жидкий полимер, вынимается и высушивается - и так раз за разом, пока на поверхности матрицы не создается многослойная плоть сердца. Рабочая камера по форме аналогична корпусу. Ее изготавливали из латексной резины, а потом из силикона. Конструктивной особенностью рабочей камеры является различная толщина стенок, в которых различают активные и пассивные участки. Конструкция рассчитана таким образом, что даже при полном напряжении активных участков противоположные стенки рабочей поверхности камеры не соприкасаются между собой, чем устраняется травма форменных элементов крови. Российский конструктор Александр Дробышев, несмотря на все трудности, продолжает создавать новые современные конструкции «Поиска», которые будут значительно дешевле зарубежных образцов. Одна из лучших на сегодня зарубежных систем «Искусственное сердце» «Новакор» стоит 400 тысяч долларов. С ней можно целый год дома ждать операции. В кейсе-чемоданчике «Новакора» находятся два пластмассовых желудочка. На отдельной тележке наружный сервис компьютер управления, монитор контроля, который остается в клинике на глазах у врачей. Дома, с больным блок питания, аккумуляторные батареи, которые сменяются и подзаряжаются от сети. Задача больного - следить за зеленым индикатором ламп, показывающих заряд аккумуляторов.
3. Искусственная кожа
Стадия разработки: исследователи на пороге создания настоящей кожи Созданная в 1996 году искусственная кожа используется для пересадки пациентам, чей кожных покров был сильно поврежден сильными ожогами. Метод состоит в связывании коллагена, полученного из хрящей животных, с гликозаминогликаном (ГАГ) для развития модели внеклеточной матрицы, которая создает основание для новой кожи. В 2001 году на основе этого метода была создана самовосстанавливающаяся искусственная кожа. Еще одним прорывом в области создания искусственной кожи стала разработка английских ученых, которые открыли удивительный метод регенерации кожи. Созданные в лабораторных условиях клетки, генерирующие коллаген, воспроизводят реальные клетки человеческого организма, которые не дают коже стареть. С возрастом количество этих клеток уменьшается, и кожа начинает покрываться морщинами. Искусственные клетки, введенные непосредственно в морщины, начинают вырабатывать коллаген и кожа начинает восстанавливаться. В 2010 году - Ученые из университета Гранады создали искусственную человеческую кожу при помощи тканевой инженерии на основе арагозо-фибринного биоматериала. Искусственная кожа была привита мышам и показала оптимальные результаты в плане развития, мейоза и функциональности. Это открытие позволит найти ей клиническое применение, а также применение в лабораторных тестах на тканях, что, в свою очередь, позволит избежать использования лабораторных животных. Более того, открытие может быть использовано при разработке новых подходов к лечению кожных патологий. Исследование проводил Хосе Мария Хименес Родригес (Jose Maria Jimenez Rodriguez) из исследовательской группы тканевой инженерии при факультете гистологии Университета Гранады под руководством профессоров Мигеля Аламиноса Мингоранса (Miguel Alaminos Mingorance), Антонио Кампоса Муноса (Antonio Campos Munoz) и Хосе Мигеля Лабрадор Молина (Jose Miguel Labrador Molina). Исследователи сначала выбрали клетки, которые впоследствии должны были быть использованы для создания искусственной кожи. Затем проанализировали развитие культуры в лабораторных условиях и в конце концов провели контроль качества путем прививания тканей мышам. С этой целью были разработаны несколько техник иммунофлуоресцентной микроскопии. Они позволили ученым оценить такие факторы как клеточная пролиферация, наличие маркеров морфологической дифференциации, экспрессия цитокреатина, инволюкрина и филагрина; ангиогенез и рост искусственной кожи в организме реципиента. Для экспериментов исследователи взяли небольшие части человеческой кожи путем биопсии у пациентов после пластических операций в больнице University Hospital Virgen de las Nieves в Гранаде. Естественно, с согласия пациентов. Для создания искусственной кожи был использован человеческий фибрин из плазмы здоровых доноров. Затем исследователи добавили транексамовую кислоту (для предотвращения фибринолиза), хлорид кальция (для предотвращения коагуляции фибрина) и 0,1% арагозы (aragose). Эти заменители были привиты на спины голых мышей с целью наблюдения их развития в естественных условиях. Кожа, созданная в лаборатории, показала хороший уровень биосовместимости. Отторжения, расхождения или инфекции обнаружено не было. Плюс кожа на всех животных в исследовании проявила грануляцию через шесть дней после имплантации. Рубцевание завершилось в следующие двадцать дней. Эксперимент, проведенный в Университете Гранады стал первым в ходе которого искусственная кожа была создана с дермой на основе арагозо-фибринного биоматериала. До сих пор использовались другие биоматериалы вроде коллагена, фибрина, полигликолиевой кислоты, хитозана и т.д. 4. Искусственный кишечник
В 2006 году английские ученые оповестили мир о создании искусственного кишечника, способного в точности воспроизвести физические и химические реакции, происходящие в процессе пищеварения. Орган сделан из специального пластика и металла, которые не разрушаются и не подвергаются коррозии. Тогда была впервые в истории проведена работа, которая демонстрировала, как плюрипотентные стволовые клетки человека в чашке Петри могут быть собраны в ткань организма с трехмерной архитектурой и типом связей, свойственных естественно развившейся плоти. Искусственная кишечная ткань может стать терапевтическим средством №1 для людей, страдающих некротическим энтероколитом, воспалением кишечника и синдромом короткого кишечника. В ходе исследований группа ученых под руководством доктора Джеймса Уэллса использовала два типа плюрипотентных клеток: эмбриональные человеческие стволовые клетки и индуцированные, полученные путем перепрограммирования клеток человеческой кожи. Эмбриональные клетки называют плюрипотентными, потому что они способны превращаться в любой из 200 различных типов клеток человеческого организма. Индуцированные клетки подходят для «причесывания» генотипа конкретного донора, без риска дальнейшего отторжения и связанных с этим осложнений. Это новое изобретение науки, поэтому пока неясно, обладают ли индуцированные клетки взрослого организма тем же потенциалом, что и клетки зародыша. Искусственная ткань кишечника была «выпущена» в двух видах, собранная из двух разных типов стволовых клеток. Чтобы превратить отдельные клетки в ткань кишечника, потребовалось много времени и сил. Ученые собирали ткань, используя химикаты, а также белки, которые называют факторами роста. В пробирке живое вещество росло так же, как и в развивающемся эмбрионе человека. Сначала получается так называемая эндодерма, из которой вырастают пищевод, желудок, кишки и легкие, а также поджелудочная железа и печень. Но медики дали команду эндодерме развиться только лишь в первичные клетки кишечника. На их рост до ощутимых результатов потребовалось 28 дней. Ткань созрела и обрела абсорбционную и секреторную функциональность, свойственную здоровому пищеварительному тракту человека. В ней также появились и специфические стволовые клетки, с которыми теперь работать будет значительно легче. Доноров крови всегда не хватает -клиники обеспечены препаратами крови всего на 40 % от нормы. Для проведения одной операции на сердце с использованием системы искусственного обращения требуется кровь 10 доноров. Есть вероятность, что проблему поможет решить искусственная кровь - ее, как конструктор, уже начали собирать ученые. Созданы синтетические плазма, эритроциты и тромбоциты. Создание «крови» Плазма - один из основных компонентов крови, ее жидкая часть. «Пластиковая плазма», созданная в университете Шеффилда (Великобритания), может выполнять все функции настоящей и абсолютно безопасна для организма. В ее состав входят химические вещества, способные переносить кислород и питательные вещества. На сегодняшний день искусственная плазма предназначена для спасения жизни в экстремальных ситуациях, но в ближайшем будущем ее можно будет использовать повсеместно. Что ж, впечатляет. Хотя и немного страшновато представить, что внутри тебя течет жидкий пластик, точнее, пластиковая плазма. Ведь чтобы стать кровью, ее еще нужно наполнить эритроцитами, лейкоцитами, тромбоцитами. Помочь британским коллегам с «кровавым конструктором» решили специалисты из Калифорнийского университета (США). Они разработали полностью синтетические эритроциты из полимеров, способные переносить кислород и питательные вещества от легких к органам и тканям и обратно, то есть выполнять основную функцию настоящих красных кровяных клеток. Кроме того, они могут доставлять к клеткам лекарственные препараты. Ученые уверены, что в ближайшие годы завершатся все клинические испытания искусственных эритроцитов, и их можно будет применять для переливания. Правда, предварительно разбавив их в плазме - хоть в естественной, хоть в синтетической. Не желая отставать от калифорнийских коллег, искусственные тромбоциты разработали ученые из университета Case Western Reserve штата Огайо. Если быть точным, то это не совсем тромбоциты, а их синтетические помощники, тоже состоящие из полимерного материала. Их главная задача - создать эффективную среду для склеивания тромбоцитов, что необходимо для остановки кровотечения. Сейчас в клиниках для этого используют тромбоцитарную массу, но ее получение - дело кропотливое и довольно долгое. Нужно найти доноров, произвести строгий отбор тромбоцитов, которые к тому же хранятся не более 5 суток и подвержены бактериальным инфекциям. Появление искусственных тромбоцитов снимает все эти проблемы. Так что изобретение станет хорошим помощником и позволит врачам не бояться кровотечений. Настоящая или искусственная кровь. Что лучше?
Термин «искусственная кровь» немного неточен. Настоящая кровь выполняет большое количество задач. Искусственная кровь пока может выполнять только некоторые из них Если будет создана полноценная искусственная кровь, способная полностью заменить настоящую, это будет настоящий прорыв в медицине. Искусственная кровь выполняет две основные функции: 1) увеличивает объем кровяных телец 2) выполняет функции обогащения кислородом. В то время как вещество, увеличивающее объем кровяных телец, уже давно используется в больницах, кислородная терапия пока находится в стадии разработки и клинических исследований. Предполагаемые достоинства и недостатки искусственной крови Достоинство
Недостатки
отсутствие риска заражения вирусами побочные эффекты
совместимость с любой группой крови токсичность
при переливании производство в лабораторных условиях дороговизна
относительная лёгкость хранения 6. Искусственное легкое
Американские ученые из Йельского университета под руководством Лауры Никласон совершили прорыв: им удалось создать искусственное легкое и пересадить его крысам. Также отдельно было создано легкое, работающее автономно и имитирующее работу настоящего органа Надо сказать, что человеческое легкое представляет собой сложный механизм. Площадь поверхности одного легкого у взрослого человека составляет около 70 квадратных метров, собранных так, чтобы обеспечивать эффективный перенос кислорода и углекислого газа между кровью и воздухом. Но ткань легкого трудно восстанавливать, поэтому на данный момент единственный способ заменить поврежденные участки органа - пересадка. Данная процедура весьма рискованна в виду высокого процента отторжений. Согласно статистике, через десять лет после трансплантации в живых остаются лишь 10-20% пациентов. «Искусственное легкое» представляет собой пульсирующий насос, который подает воздух порциями с частотой 40-50 раз в минуту. Обычный поршень для этого не подходит, в ток воздуха могут попасть частички материала его трущихся частей или уплотнителя. Здесь, и в других подобных устройствах используют мехи из гофрированного металла или пластика - сильфоны. Очищенный и доведенный до требуемой температуры воздух подается непосредственно в бронхи.
7. Искусственные кости
Медики из Империал колледжа в Лондоне утверждают, что им удалось изготовить костный материал, который наиболее похож по своему составу на настоящие кости и имеет минимальные шансы на отторжение. Новые искусственные костные материалы фактически состоят сразу из трех химических соединений, которые симулируют работу настоящих клеток костной ткани. Медики и специалисты по протезированию по всему миру сейчас ведут разработки новых материалов, которые могли бы послужить полноценной заменой костной ткани в организме человека. Впрочем, на сегодня ученые создали лишь подобные костям материалы, пересаживать которые вместо настоящих костей, пусть и сломанных, до сих пор не доводилось. Основная проблема таких псевдо-костных материалов заключается в том, что организм их не распознает как «родные» костные ткани и не приживается к ним. В итоге, в организме пациента с пересаженными костями могут начаться масштабные процессы отторжения, что в худшем варианте может даже привести к масштабному сбою в иммунной системе и смерти пациента. Мозговые протезы
Мозговые протезы - очень сложная, однако выполнимая задача. Уже сегодня возможно внедрение в человеческий мозг специального чипа, который будет отвечать за кратковременную память и пространственные ощущения. Такой чип станет незаменимым элементом для индивидуумов, страждущих на нейродегенеративные недуги. Мозговые протезы пока еще только тестируются, однако результаты исследований показывают, что человечество имеет все шансы на замену частей мозга в будущем. Искусственные руки.
Искусственные руки в XIX в. разделялись на «рабочие руки» и «руки косметические», или предметы роскоши. Для каменщика или чернорабочего ограничивались наложением на предплечье или плечо бандажа из кожаной гильзы с арматурой, к которой прикреплялся соответствующий профессии рабочего инструмент - клещи, кольцо, крючок и т. п. Косметические искусственные руки, смотря по занятиям, образу жизни, степени образования и другим условиям, бывали более или менее сложны. Искусственная рука могла иметь форму естественной, в изящной лайковой перчатке, способная производить тонкие работы; писать и даже тасовать карты (как известная рука генерала Давыдова). Если ампутация не достигла локтевого сустава, то при помощи искусственной руки возможно было возвратить функцию верхней конечности; но если ампутировано верхнее плечо, то работа рукой была возможна лишь через посредство объемистых, весьма сложных и требующих большого усилия аппаратов. Помимо последних, искусственные верхние конечности состояли из двух кожаных или металлических гильз для верхнего плеча и предплечья, которые над локтевым суставом были подвижно соединены в шарнирах посредством металлических шин. Кисть былa сделана из легкого дерева и неподвижно прикреплена к предплечью или же подвижна. В суставах каждого пальца находились пружины; от концов пальцев идут кишечные струны, которые соединялись позади кистевого сустава и продолжались в виде двух более крепких шнурков, причем один, пройдя по валикам через локтевой сустав, прикреплялся на верхнем плече к пружине, другой же, также двигаясь на блоке, свободно оканчивался ушком. Если желают при вытянутом плече сохранить пальцы сжатыми, то это ушко вешают на пуговку, имеющуюся на верхнем плече. При произвольном сгибании локтевого сустава пальцы смыкались в этом аппарате и совершенно закрывались, если плечо согнуто под прямым углом. Для заказов искусственных рук достаточно было указать меры длины и объема культи, а равно и здоровой руки, и объяснить технику цели, которым они должны служить. Протезы для рук должны обладать всеми нужными свойствами, к примеру, функцией закрытия и открытия кисти, удержания и выпускание из рук любой вещи, и у протеза должен быть вид, который как можно точнее копирует утраченную конечность. Существуют активные и пассивные протезы рук. Пассивные только копируют внешний вид руки, а активные, которые делятся на биоэлектрические и механические, выполняют гораздо больше функций. Механическая кисть довольно точно копирует настоящую руку, так что любой человек с ампутацией сможет расслабиться среди людей, а также сможет брать предмет и выпускать его. Бандаж, который крепится на плечевом поясе, приводит кисть в движение. Биоэлектрический протез работает благодаря электродам, считывающим ток, который вырабатывается мускулами во время сокращения, сигнал передаётся на микропроцессор и протез движется. Искусственные ноги
Для человека с физическим повреждением нижних конечностей, конечно же, важны качественные протезы для ног. Именно от уровня ампутации конечности и будет зависеть правильный выбор протеза, который заменит и сможет даже восстановить множество функций, которые были свойственны конечности. Существуют протезы для людей, как молодых, так и пожилых, а также для детей, спортсменов, и тех, кто, несмотря на ампутацию, ведёт такую же активную жизнь. Протез высокого класса состоит из системы стоп, коленных шарниров, адаптеров, сделанных из материала высокого класса и повышенной прочности. Обычно при выборе протеза обращают самое пристальное внимание на будущие физические нагрузки пациента и на вес его тела. С помощью высококачественного протеза человек сможет жить, как и прежде, практически не ощущая неудобств, и даже выполнять ремонт в доме, закупать кровельные материалы и делать другие виды силовых работ. Чаще всего все отдельные детали протеза делают из самых прочных материалов, к примеру, из титана или легированной стали. Если человек весит до 75 кг, то ему подбирают более лёгкие протезы из других сплавов. Существуют небольшие модули, специально разработанные для детей от 2 до 12 лет. Для многих людей с ампутацией стало настоящим спасением появление протезно - ортопедических компаний, которые выполняют протезы под заказ для рук и ног, изготавливают корсеты, стельки, ортопедические аппараты.
Заключение
Современная медицинская техника позволяет заменять полностью или частично больные органы человека. Электронный водитель ритма сердца, усилитель звука для людей, страдающих глухотой, хрусталик из специальной пластмассы - вот только некоторые примеры использования техники в медицине. Все большее распространение получают также биопротезы, приводимые в движение миниатюрными блоками питания, которые реагируют на биотоки в организме человека. Во время сложнейших операций, проводимых на сердце, легких или почках, неоценимую помощь медикам оказывают «Аппарат искусственного кровообращения», «Искусственное легкое», «Искусственное сердце», «Искусственная почка», которые принимают на себя функции оперируемых органов, позволяют на время приостановить их работу. Таким образом, искусственные органы имеют огромное значение в современной медицине.
Список использованной литературы
1.Искусственная почка и её клиническое применение, М., 1961; Fritz К. W., Hämodialyse, Stuttg., 1966.. Буреш Я. Электрофизиологические методы исследования. Медиина. М., 1973. Трансплантация органов и тканей в многопрофильном научном центре, Москва, 2011, 420 стр. под ред. М.Ш. Хубутия. Отторжение трансплантированного сердца. Москва, 2005, 240 стр. Соавторы: В. И. Шумаков и О. П. Шевченко. Галлетти П. М., Бричер Г. А., Основы и техника экстракорпорального кровообращения, пер. с англ., М., 1966